Roche BenchMark ULTRA Interpretation Guide
- Tipo
- Interpretation Guide
Este manual también es adecuado para
Roche BenchMark ULTRA es un sistema de tinción automatizado diseñado para proporcionar resultados de tinción de alta calidad en un entorno de laboratorio. Con su tecnología avanzada, ofrece una amplia gama de características y beneficios que lo convierten en una herramienta valiosa en el laboratorio:
-
Procesamiento rápido: Roche BenchMark ULTRA tiñe portaobjetos de forma rápida y eficiente, lo que permite un flujo de trabajo más rápido y tiempos de respuesta más cortos.
-
Tinción precisa y reproducible: El sistema utiliza algoritmos avanzados para controlar la temperatura, el tiempo y la dispensación de reactivos, lo que garantiza resultados de tinción consistentes y reproducibles.
Roche BenchMark ULTRA es un sistema de tinción automatizado diseñado para proporcionar resultados de tinción de alta calidad en un entorno de laboratorio. Con su tecnología avanzada, ofrece una amplia gama de características y beneficios que lo convierten en una herramienta valiosa en el laboratorio:
-
Procesamiento rápido: Roche BenchMark ULTRA tiñe portaobjetos de forma rápida y eficiente, lo que permite un flujo de trabajo más rápido y tiempos de respuesta más cortos.
-
Tinción precisa y reproducible: El sistema utiliza algoritmos avanzados para controlar la temperatura, el tiempo y la dispensación de reactivos, lo que garantiza resultados de tinción consistentes y reproducibles.






































-
 1
1
-
 2
2
-
 3
3
-
 4
4
-
 5
5
-
 6
6
-
 7
7
-
 8
8
-
 9
9
-
 10
10
-
 11
11
-
 12
12
-
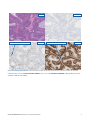 13
13
-
 14
14
-
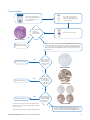 15
15
-
 16
16
-
 17
17
-
 18
18
-
 19
19
-
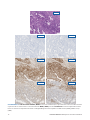 20
20
-
 21
21
-
 22
22
-
 23
23
-
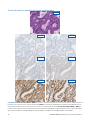 24
24
-
 25
25
-
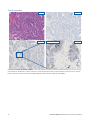 26
26
-
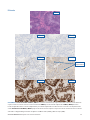 27
27
-
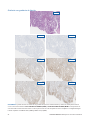 28
28
-
 29
29
-
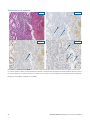 30
30
-
 31
31
-
 32
32
-
 33
33
-
 34
34
-
 35
35
-
 36
36
-
 37
37
-
 38
38
Roche BenchMark ULTRA Interpretation Guide
- Tipo
- Interpretation Guide
- Este manual también es adecuado para
Roche BenchMark ULTRA es un sistema de tinción automatizado diseñado para proporcionar resultados de tinción de alta calidad en un entorno de laboratorio. Con su tecnología avanzada, ofrece una amplia gama de características y beneficios que lo convierten en una herramienta valiosa en el laboratorio:
-
Procesamiento rápido: Roche BenchMark ULTRA tiñe portaobjetos de forma rápida y eficiente, lo que permite un flujo de trabajo más rápido y tiempos de respuesta más cortos.
-
Tinción precisa y reproducible: El sistema utiliza algoritmos avanzados para controlar la temperatura, el tiempo y la dispensación de reactivos, lo que garantiza resultados de tinción consistentes y reproducibles.
Documentos relacionados
-
Roche VENTANA anti-ALK D5F3 Primary Antibody Manual de usuario
-
Roche uPath PD-L1 image analysis for NSCLC IVD Algorithm Manual de usuario
-
Roche VENTANA PD-L1 (SP263) Assay, Universal, CE IVD, Predictive, NSCLC Interpretation Guide
-
Roche uPath IVD Manual de usuario
-
Roche NAVIFY Mutation Profiler Manual de usuario
Otros documentos
-
Sonel MMR-6700 Manual de usuario
-
 Thermo Fisher Scientific HLA Typing Trays Instrucciones de operación
Thermo Fisher Scientific HLA Typing Trays Instrucciones de operación
-
 Hologic NovaSure Instrucciones de operación
Hologic NovaSure Instrucciones de operación
-
 Hologic NovaSure Instrucciones de operación
Hologic NovaSure Instrucciones de operación
-
 Hologic ThinPrep Stain Bluing II Solution Instrucciones de operación
Hologic ThinPrep Stain Bluing II Solution Instrucciones de operación
-
 Hologic ThinPrep 5000 Processor El manual del propietario
Hologic ThinPrep 5000 Processor El manual del propietario
-
Leica HMB45 Manual de usuario










































