Roche VENTANA PD-L1 (SP263) Assay, Universal, CE IVD, Predictive, NSCLC Interpretation Guide
- Tipo
- Interpretation Guide

VENTANA PD-L1 (SP263) Assay Staining
of Non-Small Cell Lung Cancer
Guía de interpretación

2 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 3
Tabla de contenido
Introducción 5
Uso previsto 6
Uso previsto del producto 6
Objetivo de la Guía de interpretación 6
Evaluación 7
Evaluación de patrones de tinción de células tumorales e intensidades 7
Patrones de tinción de células inmunitarias 10
Requisitos del tejido 14
Criterios de aceptabilidad de morfología y fondo 14
Control de tejido positivo 15
Criterios de puntuación 16
Tabla de puntuación de PD-L1 16
Evaluación del porcentaje de tinción de la membrana 17
Atlas de expresión de PD-L1 en NSCLC 18
Galería de fotos 18
Características complejas 32
Impacto de las condiciones preanalíticas en la tinción
con VENTANA PD-L1 (SP263) Assay 49
Recomendaciones de fijador para lograr resultados de tinción óptimos
con el VENTANA PD-L1 (SP263) Assay 49
Impacto del grosor del tejido en la tinción del ensayo VENTANA PD-L1 (SP263) Assay 50
Estabilidad de los portaobjetos con cortes 50
Bibliografía 51

4 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 5
Introducción
El cáncer de pulmón es, desde hace varias décadas, el cáncer
más común y la principal causa de muerte relacionada con esta
enfermedad a nivel mundial. Se estima que representa el 12.9%
de todos los nuevos casos de cáncer y causa casi 1.59 millones de
muertes al año en todo el mundo o, lo que es lo mismo, es la causa de
una de cada cinco muertes relacionadas con el cáncer
1
. Aunque se han
incorporado mejoras en las opciones de diagnóstico y tratamiento, el
pronóstico sigue siendo desfavorable, con tasas bajas de supervivencia
a largo plazo en todas las fases. Durante los últimos 30 años, se ha
comprobado que el cáncer de pulmón muestra la menor mejora en los
índices de supervivencia en comparación con otros tipos de cáncer.
2
El cáncer de pulmón no microcítico (NSCLC), uno de los dos tipos
de cáncer principales, representa aproximadamente el 85% de los
casos de cáncer de pulmón
3
. En más de la mitad de los pacientes que
se diagnostican con NSCLC, la enfermedad ya ha alcanzado la fase
de metástasis, lo que disminuye en gran medida la probabilidad de
supervivencia. El índice de supervivencia relativo a 5años para los
pacientes diagnosticados con NSCLC como enfermedad distante es
del 4.7%
3
. La mayoría de los pacientes con NSCLC presentan una
enfermedad localmente avanzada e inoperable (fase IIIB) o metastásica
(fase IV). Actualmente, no existen opciones de tratamiento curativo
para ninguna de las dos y, de media, estos pacientes mueren en un
plazo de un año desde el diagnóstico. Existen posibilidades de mejora
en el resultado clínico del cáncer de pulmón si se conocen mejor los
acontecimientos moleculares que subyacen a la patogénesis con el
fin de identificar nuevas dianas de biomarcadores y desarrollar nuevas
opciones de tratamiento.
PD-L1 es una proteína transmembrana que disminuye las respuestas
inmunitarias mediante la unión a dos sus receptores inhibidores de
muerte programada-1 (PD-1) y B7-1 (CD80).
4
PD-1 es un receptor
inhibidor que se expresa en los linfocitos T tras su activación y se
mantiene en estados de estimulación crónica, como en infección
crónica o cáncer.
5
La unión de PD-L1 con PD-1 inhibe la proliferación
de los linfocitos T, la producción de citoquinas y la actividad citolítica,
dando lugar a la inactivación funcional o agotamiento de los linfocitos
T. CD80 es una molécula expresada en células presentadoras de
antígenos y células T activadas. La unión de PD-L1 a CD80 sobre
células T y células presentadoras de antígeno puede mediar la
regulación por disminución de respuestas inmunes, incluyendo la
inhibición de la activación de células T y la producción de citoquinas
6
.
La expresión de PD-L1 se ha observado en células inmunitarias y en
células tumorales
7.8
. Se ha notificado que la expresión aberrante de
PD-L1 en células tumorales impide la inmunidad antitumoral, dando
como resultado una evasión inmune
5.8
. Por lo tanto, la interrupción de
la vía PD-L1/PD-1 representa una estrategia atractiva para revigorizar
la inmunidad de las células T específicas de tumor suprimida por la
expresión de PD-L1 en el microentorno tumoral. PD-L1 se expresa
en una amplia variedad de cánceres incluyendo cáncer de pulmón,
melanoma, urotelial, ovárico y colorrectal. Se ha comunicado la
prevalencia de la expresión de PD-L1 del 12% al 100% en función del
tipo de tumor, del clon anti-PD-L1 y del valor de corte de la positividad
9
.
El VENTANA PD-L1 (SP263) Assay es un anticuerpo primario
monoclonal de conejo que se produce contra el ligando de muerte
programada 1 (PD-L1) homólogo 1 de B7 (B7-H1, CD274). Reconoce
una glucoproteína unida a la transmembrana con una masa molecular
de 45-55 kDa.
El anticuerpo VENTANA PD-L1 (SP263) se desarrolló en Spring
BioScience. El producto es un reactivo a anticuerpos prediluído
destinado al uso en instrumentos BenchMark IHC/ISH con OptiView
DAB IHC Detection Kit, y utiliza la Guía de interpretación de VENTANA
PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer.

6 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Uso previsto del producto
Consulte la ficha del método del VENTANA PD-L1 (SP263) Assay
para ver información sobre el uso previsto de este producto.
Nota: Es posible que el uso de este diagnóstico con los
tratamientos indicados no haya sido aprobado en todos los
países. Póngase en contacto con el representante de Roche para
consultar qué aprobaciones son necesarias a nivel local.
Objetivo de la Guía de interpretación
Esta guía está prevista para ayudar a los anatomopatólogos a evaluar
los cortes de NSCLC fijados con formol, embebidos en parafina (FFPE)
y teñidos con el VENTANA PD-L1 (SP263) Assay, usando el VENTANA
PD-L1 (SP263) Scoring Algorithm de acuerdo con el etiquetado del
producto propuesto. En concreto, esta guía:
• Proporciona imágenes fotográficas que ilustran los posibles
patrones e intensidades de tinción resultantes de la tinción de
tejidos de NSCLC con el ensayo VENTANA PD-L1 (SP263) Assay.
• Brinda ejemplos de casos complicados.
• Analiza otros controles que se pueden utilizar con el análisis pero
no son proporcionados por Ventana.
Uso previsto

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 7
Evaluación
Las células neoplásicas de NSCLC marcadas con el ensayo VENTANA
PD-L1 (SP263) Assay se evalúan para verificar la positividad del
porcentaje de células tumorales con tinción de la membrana a
cualquier intensidad de la señal de diaminobencidina (DAB). La tinción
inmunohistoquímica en el NSCLC es membranosa y/o citoplasmática,
y se puede expresar homogénea o hetereogéneamente por todo el
neoplasma. La tinción de la membrana puede presentar un patrón
discontinuo, circunferencial o basolateral.
La tinción citoplásmica generalmente es difusa y algunos casos
presentan una calidad finamente granular. Algunos casos excepcionales
han presentado una tinción de los cuerpos puntiformes perinucleares
con intensidad variable. El porcentaje total de las intensidades de la
señal de la membrana tumoral se estima visualmente y se utiliza para
generar el nivel de expresión de PD-L1. La tinción citoplasmática de
células tumorales no se tiene en cuenta para determinar la expresión
de PD-L1. Se utiliza un anticuerpo de control negativo compatible con
isotipo para evaluar la presencia de fondo en las muestras de la prueba y
establecer una línea de base de la intensidad de tinción.
NSCLC, H&E y VENTANA PD-L1 (SP263) Assay: diversos casos que demuestran el rango de tinción citoplasmática y de la membrana de las
células tumorales (aumento 20X).
Evaluación de patrones de tinción de células tumorales
e intensidades

8 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
NSCLC, H&E y VENTANA PD-L1 (SP263) Assay: células tumorales con patrón basolateral de la tinción de la membrana (aumento 20X).
NSCLC, H&E y VENTANA PD-L1 (SP263) Assay: caso poco común con tinción puntiforme perinuclear dentro de las células tumorales (aumento 40X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 9
NSCLC, H&E y VENTANA PD-L1 (SP263) Assay: en casos con un patrón mayormente basolateral de la tinción de la membrana tumoral, solamente
deberán incluirse en la estimación porcentual las células con una expresión definitiva de células tumorales (la flecha roja señala las células
tumorales con una tinción lateral de la membrana de las células tumorales). Las áreas donde la tinción pueda atribuirse a células inmunitarias,
elementos estromales o membrana basal, y no a una tinción tumoral definitiva, deberán descartarse (la flecha azul indica la tinción debajo de las
células tumorales sin tinción lateral) (aumento 20X).

10 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Patrones de tinción de células inmunitarias
Las células inmunitarias muestran diferentes grados de intensidad en
la tinción: negativa, citoplasmática difusa débil y/o señal membranosa
de débil a intensa. Puede observarse un patrón punteado de tinción
en asociación con linfocitos. La expresión de PD-L1 se ha observado
en linfocitos, macrófagos, histiocitos, células plasmáticas y neutrófilos.
A continuación se muestran imágenes representativas de células
inmunitarias teñidas con VENTANA PD-L1 (SP263) Assay como
referencia para ayudar al anatomopatólogo a diferenciar entre tinción
de células tumorales y de células inmunitarias. Para determinar el nivel
de expresión de PD-L1, se hace caso omiso a la tinción de las células
inmunitarias. NOTA: Las células inmunitarias no son fiables como
control interno positivo.
NSCLC y H&E: células tumorales con macrófagos alveolares (flecha)
(aumento 20X).
NSCLC y VENTANA PD-L1 (SP263) Assay: tinción positiva de
macrófagos alveolares (flecha) con tumor negativo a PD-L1 adyacente,
cero por ciento de tinción (aumento 20X).
NSCLC y H&E: células tumorales con células inmunitarias linfocíticas y
plasmáticas (aumento 20X).
NSCLC y VENTANA PD-L1 (SP263) Assay: tinción de células
inmunitarias difusas (flecha negra) y puntiformes (flecha azul)
con tumor negativo a PD-L1 adyacente, cero por ciento de tinción
(aumento 20X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 11
NSCLC, H&E y VENTANA PD-L1 (SP263) Assay: con un aumento de 4X (paneles superiores), el patrón de tinción parece contener una tinción
significativa de la membrana tumoral. El análisis con un aumento mayor (20X, panel inferior) revela que el tumor es principalmente negativo para
PD-L1, con tinción de células inmunitarias membranosa (flecha negra) y puntiforme (flecha azul). También se aprecia tinción celular dendrítica
(flecha roja).

12 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
NSCLC, H&E y VENTANA PD-L1 (SP263) Assay: células plasmáticas con tinción citoplasmática de difusa a moderada. Las células tumorales
circundantes no demuestran tinción (aumento 20X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 13
NSCLC, H&E y VENTANA PD-L1 (SP263) Assay: los neutrófilos de H&E muestran expresión de PD-L1 (flecha azul). El caso presenta también una
tinción moderada de la membrana de las células tumorales (flecha negra) (aumento 40X).

14 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Requisitos del tejido
El ensayo VENTANA PD-L1 (SP263) Assay requiere un corte de tejido
en serie para la tinción de hematoxilina y eosina (H&E), un segundo
corte de tejido en serie para la tinción de anticuerpos de control
negativo y un tercer corte de tejido en serie para la tinción con el
ensayo VENTANA PD-L1 (SP263) Assay. Además, puede utilizarse
tejido placentario humano normal como control para el ensayo
VENTANA PD-L1 (SP263) Assay. Este tejido muestra una tinción
uniforme de moderada a fuerte de la membrana y una tinción uniforme
de débil a fuerte del citoplasma en las células de linaje trofoblástico.
La vasculatura y el tejido estromal placentario se pueden utilizar para
la evaluación de una tinción de fondo. Si la muestra es inadecuada
de acuerdo con la evaluación de H&E, deberá obtenerse una nueva
muestra. La repetición de la tinción de una muestra debe llevarse
a cabo en portaobjetos sin teñir si (1) el portaobjetos de control de
tejido no muestra una tinción aceptable; (2) el portaobjetos de control
negativo no muestra una tinción aceptable; o (3) el portaobjetos
teñido con VENTANA PD-L1 (SP263) Assay (el portaobjetos PD-L1
IHC) no es evaluable. Si el último de estos portaobjetos no puede
interpretarse debido a artefactos, efectos de borde, necrosis, falta
de tejido o cualquier otra razón, el portaobjetos no podrá utilizarse
para la evaluación clínica. Si los controles son aceptables y el
portaobjetos teñido con VENTANA PD-L1 (SP263) Assay es evaluable,
el portaobjetos podrá evaluarlo un anatomopatólogo cualificado como
se describe en los criterios de puntuación.
Criterios de aceptabilidad de morfología y fondo
La morfología del tejido y la aceptabilidad de fondo se evalúan para cada caso clínico utilizando los criterios descritos en las Tablas 1 y 2.
Tabla 1: Criterios de aceptabilidad de la morfología
Interpretación Observación microscópica
Aceptable Se visualizan los elementos celulares de interés, permitiendo la interpretación clínica de la tinción.
Inaceptable No se visualizan los elementos celulares de interés, comprometiendo la interpretación clínica de la tinción.
Tabla 2: Criterios de aceptabilidad del fondo
Interpretación Descripción de la tinción
Aceptable Tinción no específica que no interfiere con la interpretación de tinción específica.
Inaceptable Tinción no específica que interfiere con la interpretación de tinción específica.

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 15
Control de tejido positivo
Se debe analizar un tejido de control positivo conocido, fijado y
procesado de la misma manera que las muestras del paciente, para
cada conjunto de condiciones de análisis y con cada procedimiento
de tinción realizado con VENTANA PD-L1 (SP263) Assay. El tejido de
control (un caso índice) debe ser una muestra fresca de autopsia,
biopsia o cirugía, preparada y fijada con la mayor brevedad con un
proceso idéntico a las muestras del paciente. Este tejido debe utilizarse
para controlar todos los pasos de procesamiento y tinción de la
muestra. Los cortes de tejido fijados o procesados de forma diferente
a la muestra de la prueba se pueden utilizar como control de los
reactivos y tinción, pero no para la fijación o la preparación del tejido.
Un caso de NSCLC positivo con tinción moderada es más adecuado
para el control de calidad que uno con una tinción intensa. Puede
utilizarse para detectar niveles menores de degradación del reactivo o
problemas externos a la muestra que pueden estar relacionados con el
instrumento. La tinción de membrana positiva de células neoplásicas
en el tejido de control confirma que se aplicó el anticuerpo VENTANA
PD-L1 (SP263) y que el instrumento funcionó correctamente. El control
tisular positivo solo debe utilizarse para supervisar el rendimiento; no
debe usarse como ayuda para el diagnóstico clínico de las muestras del
paciente. Asimismo, el ensayo VENTANA PD-L1 (SP263) Assay puede
utilizarse como control positivo del tejido placentario humano, que
muestra una tinción uniforme de moderada a fuerte de la membrana y
una tinción uniforme de débil a fuerte del citoplasma de las células de
linaje trofoblástico. La vasculatura y el tejido estromal placentario se
pueden utilizar para la evaluación de una tinción de fondo.
Placenta y VENTANA PD-L1 (SP263) Assay: tinción uniforme
fuerte de la membrana y tinción moderada del citoplasma de las
células de linaje trofoblástico (aumento 10X).
Placenta y VENTANA PD-L1 (SP263) Assay: el estroma y la
vasculatura en la vellosidad no muestran tinción de PD-L1
(aumento 20X).
Tabla 3: Criterios de evaluación del control de tejido de placenta para VENTANA PD-L1 (SP263) Assay
Interpretación Descripción de la tinción
Aceptable
Tinción uniforme de la membrana de las células de linaje trofoblástico de moderada a fuerte
y
el estroma placentario y la vasculatura no presentan tinción.
Inaceptable
Tinción uniforme de la membrana de las células de linaje trofoblástico de inexistente a débil
y/o
tinción específica dentro del estroma placentario y el tejido vascular.

16 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Criterios de puntuación
El patólogo debidamente formado asigna una puntuación IHC de
PD-L1 basada en su evaluación de la frecuencia de tinción IHC de
PD-L1 específica de la membrana de las células tumorales. Se asigna
un nivel de expresión a los casos, tal y como se describe en la Tabla de
puntuación de PD-L1.
Los casos no evaluables incluyen, entre otros, casos con tumor viable
insuficiente, interferencia del fondo o descalcificación. Los casos
de NSCLC con suficientes células tumorales viables (en función
de la puntuación del patólogo) y sin interferencias del fondo en el
portaobjetos IHC de PD-L1 se aceptan para su evaluación.
En las siguientes secciones se proporcionan imágenes de diversos
patrones de tinción y expresión.
Tabla de puntuación de PD-L1
Tabla 4: Puntuación de PD-L1
Evaluar y enumerar el porcentaje de células tumorales con positividad de membrana para PD-L1 a cualquier intensidad sobre la tinción de fondo como se indica en el
correspondiente control de isotipo negativo. El nivel de expresión de PD-L1 se indica como un número entero.

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 17
Evaluación del porcentaje de tinción de la membrana
La siguiente guía ilustrada muestra, únicamente a título orientativo,
un espectro cuantitativo de la tinción de la membrana de las células
tumorales en un campo de muestra de NSCLC que contiene células
tumorales viables únicamente a título orientativo. Se han ilustrado
niveles de expresión de 0% a 100% de células tumorales con tinción
de membrana como un indicador representativo para ayudar al
anatomopatólogo a evaluar la tinción de PD-L1. La suficiencia de la
muestra se determina a discreción del anatomopatólogo.

18 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Atlas de expresión de PD-L1 en NSCLC
La tinción se caracteriza por la presencia de cualquier señal detectable
sobre el fondo, como se observa en el correspondiente control de
isotipo negativo mediante tinción membranosa de células neoplásicas.
Este atlas de expresión contiene ejemplos de niveles de expresión en
varios campos de visión. La tinción débil de la membrana de células
tumorales no se distingue con facilidad con baja potencia y puede
requerir un examen paciente y metódico del portaobjetos teñido a
mayor potencia, especialmente en los casos en los que acompaña una
tinción citoplásmica débil.
Conjunto de imágenes n.º1. Tinción de células tumorales e inmunitarias
negativo (cero por ciento) (aumento 20X).
Galería de fotos
Para los casos que presenten una expresión de PD-L1 en el extremo
inferior del espectro, deberá identificarse cualquier tinción de la
membrana histiocítica o del macrófago alveolar para evitar que se
interprete incorrectamente como tinción de células tumorales. La
revisión del portaobjetos de H&E puede facilitar la diferenciación
entre células inmunitarias y tumorales. Puesto que la diferencia entre
menos del 1% y 1% de la expresión de PD-L1 es sutil, contar las
células (ya sea contando el número total de células tumorales con
tinción de membrana y comparándolo con el número total de células
tumorales viables, o contando grupos de células tumorales con tinción
de membrana relativos al tumor viable completo) puede permitir al
anatomopatólogo adaptarse a niveles de expresión tan ligeros.

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 19
Conjunto de imágenes n.º2. Menos del 1% de células tumorales con tinción de la membrana (círculos azules). Células inmunitarias dispersas
que presentan una tinción puntiforme citoplasmática y de la membrana (flechas negras) (aumento 10X).

20 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Conjunto de imágenes n.º3. Tumor con un 1% de células tumorales con tinción de la membrana (círculos azules). Presencia de macrófagos
alveolares dispersos con tinción de la membrana débil en los lúmenes (flechas negras) (aumento 10X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 21
Conjunto de imágenes n.º4. Tumor con un 3% de células tumorales con tinción de la membrana (círculos azules). Células inmunitarias
dispersas que presentan principalmente una tinción puntiforme (flechas negras y círculos) (aumento 10X).

22 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Conjunto de imágenes n.º5. Tumor con un 5% de células que presentan tinción de la membrana (delineadas en azul). El área del tumor
(que consta de tumor viable, así como desmoplasia e inflamación circundantes) contiene áreas focales con células inmunitarias que muestran
expresión de PD-L1 (aumento 4X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 23
Conjunto de imágenes n.º6. Tumor con un 10% de células que presentan tinción de la membrana de leve a moderada (delineadas en azul) en
este campo. Células inmunitarias dispersas con expresión de PD-L1 (delineadas en negro) (aumento 10X).

24 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Conjunto de imágenes n.º7. Tumor con un 15% de células que presentan tinción de la membrana (delineadas en azul). También se aprecia
tinción de las células inmunitarias asociada al tumor (aumento 2X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 25
Conjunto de imágenes n.º8. Tumor con un 20% de células que presentan una leve tinción de la membrana en este campo (delineadas en
azul). El área del tumor contiene algunas células inmunitarias con expresión de PD-L1 (delineadas en negro) (aumento 10X).

26 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Conjunto de imágenes n.º9. Tumor con un 25% de células que presentan tinción de la membrana en este campo (delineadas en azul). El área
del tumor contiene algunas células inmunitarias con expresión de PD-L1 (delineadas en negro). Las áreas de necrosis pueden mostrar tinción y
deberían descartarse (delineadas en verde) (aumento 4X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 27
Conjunto de imágenes n.º10. Tumor con un 35% de células que presentan tinción de la membrana en este campo (delineadas en azul). El
área del tumor contiene algunas células inmunitarias con expresión de PD-L1 (delineadas en negro) (aumento 4X).

28 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Conjunto de imágenes n.º11. Tumor con un 50% de células que presentan tinción de la membrana en este campo (delineadas en azul).
El área del tumor (que consta de tumor viable, así como desmoplasia e inflamación circundantes) contiene algunas células inmunitarias con
expresión de PD-L1 (delineadas en negro). Las áreas de necrosis con tinción están delineadas en verde y deberían descartarse (aumento 4X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 29
Conjunto de imágenes n.º12. Tumor con un 70% de células que presentan tinción de la membrana en este campo (delineadas en azul). El
área del tumor contiene células inmunitarias con expresión de PD-L1 (delineadas en negro). Cualquier tinción en las áreas necróticas debería
descartarse (delineadas en verde) (4X).
Los casos que presentan más de un 50% de células tumorales con
tinción de la membrana pueden estimarse con mayor reproducibilidad
y precisión si se evalúa el porcentaje de células tumorales sin tinción
de la membrana y, posteriormente, se resta del 100% para hallar el
nivel de expresión de PD-L1 final.

30 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Conjunto de imágenes n.º13. Tumor con un 80% de células que presentan tinción de la membrana en este campo. La estimación de las
células tumorales sin tinción de la membrana (contornos rojos) y, posteriormente, la resta del 100% para hallar el porcentaje final de células
tumorales con tinción de la membrana puede ser más exacta y reproducible (10X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 31
Conjunto de imágenes n.º15. Tinción positiva de la membrana de las células tumorales (100%) sin tinción de células inmunitarias asociada al
tumor (aumento 20X).
Conjunto de imágenes n.º14. Tinción de la membrana de las células tumorales al 100% (aumento 4X).

32 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Características complejas
Diversos patrones de tinción y características morfológicas pueden
dificultar la interpretación y cuantificación de la tinción de la
membrana tumoral.
Algunos casos pueden resultar especialmente difíciles debido a los
siguientes factores:
• Tinción citoplasmática débil
Algunas muestras pueden presentar una tinción citoplasmática
débil de las células tumorales que, con un aumento bajo, puede
confundirse con una tinción débil de la membrana de las células
tumorales. Por este motivo, al evaluar los portaobjetos teñidos con
el ensayo VENTANA PD-L1 (SP263) Assay, deberá confirmarse
la tinción débil con un análisis con un aumento mayor para
distinguir entre la tinción citoplasmática y la de la membrana en
las células tumorales.
• Tinción fuerte de células inmunitarias que se solapa
con la tinción de células tumorales
Algunos tumores pueden contener un importante componente
inflamatorio que rodea el tumor y se infiltra en él. En los casos en
los que se aprecie una tinción fuerte tanto en células inmunitarias
como tumorales, puede resultar difícil diferenciar y cuantificar
el nivel de expresión de PD-L1 de las células tumorales. La
presencia de células inmunitarias que se infiltran en el tumor
deberá confirmarse con el portaobjetos de H&E. El patrón de
tinción de PD-L1 junto con las características del núcleo celular
se utilizan para facilitar la atribución de expresión a las células
inmunitarias (tinción punteada) y a las células tumorales (tinción
lineal de la membrana).
• Material de oscurecimiento endógeno y exógeno
En ocasiones, en las muestras de NSCLC, el material endógeno
y/o exógeno (como el pigmento antracótico, el pigmento
melánico o la hemosiderina) puede oscurecer e interferir con
la interpretación de la tinción de las células inmunitarias y
tumorales del ensayo VENTANA PD-L1 (SP263) Assay. Comparar
el portaobjetos de control negativo de isotipo con el portaobjetos
teñido de PD-L1 puede ayudar a diferenciar entre la tinción de
biomarcadores y el material endógeno o exógeno. En tumores
de NSCLC con una formación significativa de queratina, puede
provocarse una respuesta histiocítica en forma de células
gigantes de cuerpos extraños. Tal respuesta inmunitaria puede
ocasionar la confusión de la tinción de las células tumorales con
la tinción membranosa de las células gigantes.
• Heterogeneidad
Cuando se observa una distribución heterogénea de la expresión,
estimar el porcentaje total de tinción de la membrana tumoral
puede resultar difícil. Puede resultar útil un enfoque sistemático
dividiendo el tumor en cantidades más pequeñas pero iguales
de tumor viable, evaluándolas a continuación para determinar el
porcentaje de células tumorales con membrana y calculando el
promedio.
• Tipo de muestra de citología aspirada con aguja fina
(FNA)
Las muestras de bloques celulares FFPE de FNA presentan
retos únicos para la interpretación del PD-L1 SP263. Dado que
las células tumorales FNA pueden aparecer dispersas por una
amplia área del portaobjetos, hay una mayor probabilidad de
pasar por alto células tumorales con tinción positiva o negativa,
lo que ocasionaría un porcentaje de TC positivas poco preciso en
la evaluación. Los bloques celulares de FNA tienden a ser menos
celulares que la biopsia y las muestras de resección. Por lo tanto,
las impresiones en la estimación gestalt de las células de tinción
positiva pueden ocasionar grandes diferencias en el porcentaje
de positividad. Por este motivo, se recomienda examinar
cuidadosamente el portaobjetos H&E e IHC para asegurarse de
que el anatomopatólogo tiene en cuenta toda la zona tumoral.
Las muestras de los bloques celulares de FNA no tienen la
estructura o los puntos de referencia que suele haber en las
muestras de biopsia y resección. Por lo tanto, se debe confiar en
la morfología celular para determinar si la célula que se tiñe no es
tumoral (linfocitos, granulocitos o macrófagos) o sí lo es. Estudie
cuidadosamente las morfologías de las células no tumorales y
tumorales en la H&E y aplique estos conocimientos visuales a
las poblaciones celulares del portaobjetos teñido con VENTANA
PD-L1 (SP263) Assay a fin de reducir o eliminar los errores de
identificación celular.
La determinación de la tinción citoplásmica frente a la tinción
membranosa puede ser particularmente problemática en las
muestras de FNA. Puede ser necesaria una resolución de alta
potencia para determinar la localización específica (membranosa
o citoplasmática) de la señal DAB.
En las siguientes páginas se muestran algunos ejemplos de casos
difíciles.

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 33
Caso difícil n.º1. Caso de NSCLC teñido con el ensayo VENTANA PD-L1 (SP263) Assay con tinción citoplasmática débil (flecha negra) y
tinción membranosa débil (flecha verde) de la célula tumoral. Se necesita un análisis con un aumento mayor para diferenciar entre la tinción débil
citoplasmática y membranosa. También se aprecia tinción de macrófagos alveolares (flecha roja). En este campo, el 10% de las células tumorales
muestra una tinción de la membrana (aumento 20X).

34 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Caso difícil n.º2. Caso de NSCLC teñido con el ensayo VENTANA PD-L1 (SP263) Assay con tinción débil de la membrana tumoral (flecha
negra). Se aprecia que muchas células tumorales van acompañadas de un rubor citoplasmático. En este campo, el 90% de las células tumorales
muestra una tinción de la membrana (aumento 20X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 35
Caso difícil n.º3. El tumor presenta células con tinción membranosa débil y tinción citoplasmática débil (flecha negra), y solamente tinción
membranosa débil (flecha azul). En este campo, el 90% de las células tumorales muestra una tinción de la membrana (aumento 20X).

36 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Caso difícil n.º4. Tinción membranosa frente a tinción citoplasmática en una muestra de bloque celular de FNA. Esta imagen presenta un rubor
citoplasmático difuso (flecha azul), una tinción débil de la membrana de las células tumorales (flecha roja) y una tinción poco frecuente moderada
de la membrana de las células tumorales (flecha negra). Al igual que con las resecciones y las biopsias, puede ser complicado diferenciar el rubor
citoplasmático difuso de las muestras de FNA de la tinción membranosa (20x).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 37
Caso difícil n.º5. Distinción de macrófagos (flechas azules) de células tumorales (flecha negra) en una muestra de FNA. La morfología celular,
la relación nuclear-citoplasmática y el tamaño de las células pueden emplearse para diferenciar la tinción de macrófagos de la tinción de TC.
Este caso también presenta un rubor citoplasmático en algunas de las células tumorales (flecha roja), que no cuenta para la estimación de la
puntuación de % TC (10x).

38 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
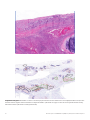
Caso difícil n.º6. Caso de NSCLC teñido con el ensayo VENTANA PD-L1 (SP263) Assay con una considerable inflamación entremezclada. Se
aprecia una tinción de la membrana de las células inmunitarias (flecha negra) y una tinción puntiforme de las células inmunitarias (flecha azul)
entremezclada con las células tumorales, que muestran una tinción membranosa parcialmente lineal (flecha roja). En este campo, el 40% de las
células tumorales muestra tinción de la membrana. Se aprecia un tumor gravemente inflamado con H&E (aumento 40X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 39
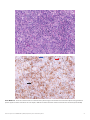
Caso difícil n.º7. Tinción de la membrana de las células tumorales (flecha negra) entremezclada con tinción difusa (flecha azul) y puntiforme
(flecha roja) de las células inmunitarias. En este campo, el 100% de las células tumorales muestra una tinción de la membrana (aumento 20X).

40 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Caso difícil n.º8. Tinción punteada de las células inmunitarias intratumorales en una muestra de FNA. Las células inmunitarias intratumorales
que aquí se muestran presentan un patrón de tinción punteada (flechas azules). Este caso también presenta una contratinción pálida, que podría
dificultar la identificación de las células del portaobjetos (10x).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 41
Caso difícil n.º9. Imagen con mayor aumento que muestra la tinción punteada de las células inmunitarias intratumorales en una muestra de
FNA. Las células inmunitarias intratumorales que se muestran presentan un patrón de tinción punteada (flechas azules; 20x).

42 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
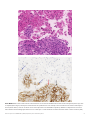
Caso difícil n.º10. Caso de NSCLC teñido con el ensayo VENTANA PD-L1 (SP263) Assay con antracosis (flecha negra) y una reacción de
células gigantes a cuerpos extraños (flecha roja) no asociada a la interpretación del caso (fila superior, aumento 20X). Un área diferente del caso
contiene pigmento antracótico (flecha negra) superpuesto a la tinción puntiforme de las células inmunitarias (flecha verde), así como tinción de la
membrana de las células tumorales (parte inferior, flecha negra). En este campo, el 80% de las células tumorales muestra tinción de la membrana
(parte inferior, 20X).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 43
Caso difícil n.º11. Tinción membranosa de células tumorales en una muestra de FNA. Tanto la tinción membranosa parcial (flecha roja) como
la completa (flecha negra) cuentan para la determinación de la puntuación de % TC. Aunque el área necrótica de esta muestra mostraba poca
tinción (flechas azules), las áreas necróticas con frecuencia presentan una señal DAB no específica y dificultan la interpretación. Los lectores
deben utilizar la histomorfología para determinar si las células que se están evaluando son células tumorales viables o células necróticas (20x).

44 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Caso difícil n.º12. Tinción membranosa de células tumorales y células inmunitarias en una muestra de FNA. En esta imagen se representan
tanto la tinción membranosa parcial (flecha roja) como la completa (flecha negra) de las células tumorales, que cuentan para la estimación
de la puntuación de % TC. Una célula inmunitaria también presenta tinción membranosa (flecha azul) y se puede distinguir, ya que es
característicamente más pequeña que las células tumorales (20x).

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 45
Caso difícil n.º13. Las células tumorales con tinción de la membrana se distribuyen de forma heterogénea por toda esta muestra (delineadas
en azul). La división del tumor en cortes de menor tamaño con cantidades iguales de tumor viable permite realizar una estimación más exacta. Se
estima el porcentaje de células tumorales con tinción membranosa en cada corte y se calcula el promedio de los cortes para determinar el nivel de
expresión de PD-L1 general. Cualquier tinción de las áreas necróticas se descarta. En este ejemplo, el porcentaje de células tumorales viables con
expresión membranosa de cada cuadrante promediado en conjunto da como resultado un nivel de expresión de PD-L1 del 50% (aumento 0.6X).
35% 25%
50%
90%

46 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Caso difícil n.º14. Tumor disperso en una muestra difusa en una muestra de FNA. Es preciso examinar cuidadosamente las muestras de FNA
para asegurarse de que se reconocen todas las células tumorales presentes. Unas pocas células tumorales que presenten tinción membranosa
específica de PD-L1 pueden afectar a la designación del estado inmunohistoquímico.

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 47
Caso difícil n.º15. Tumor disperso en una muestra difusa en una muestra de FNA. En esta muestra, un pequeño número de células tumorales
presentaban tinción membranosa (A, flechas negras). También podía apreciarse rubor citoplasmático (B, flecha azul). Este caso presenta varias
características complicadas, incluyendo una contratinción ligera, extensión difusa de las células tumorales y diferencias en las células presentes
en los portaobjetos con tinción H&E e IHC. Se le asignó a este caso una puntuación de 1% de tinción de TC.

48 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Caso difícil n.º16. Extensión difusa de células tumorales en una muestra de FNA. Las muestras de FNA con frecuencia presentan una baja
celularidad en comparación con las muestras de biopsia. Los grupos de células tumorales de este ejemplo aparecen dispersos de manera difusa
en sobre el fondo de sangre (flechas negras). Algunos grupos de TC aparecen fuera del fondo de sangre (flechas rojas). Es importante observar
con alta y baja potencia todo el portaobjetos para asegurarse de que se tienen en cuenta todas las células tumorales.

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 49
Tinción de tejido placentario en fijadores y tiempos de fijación con el VENTANA PD-L1 (SP263) Assay
Tiempo
Fijador
temporal
(horas)
NBF al 10% Zinc Formalin Fijador PREFER** AFA** Formol alcohólico** Etanol al 95%**
1*
6
12
24
48
72
Impacto de las condiciones preanalíticas en la tinción con
VENTANA PD-L1 (SP263) Assay
Recomendaciones de fijador para lograr resultados de tinción óptimos con el VENTANA PD-L1 (SP263) Assay
Ventana recomienda una fijación en NBF al 10% durante 6 a 72 horas. Los fijadores y tiempos de fijación aceptables aparecen con un contorno azul.
NOTAS
*El tiempo de fijación de una hora no se recomienda para todos los
tipos de fijador
**No se recomienda el uso de fijador PREFER y etanol al 95%
(tinción débil) o fijadores alcohólicos (alto fondo). Véanse las
imágenes adicionales con mayor aumento a la derecha.

50 Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer
Impacto del grosor del tejido en la tinción del ensayo
VENTANA PD-L1 (SP263) Assay
Ventana recomienda un grosor de tejido de 4 a 5μm para el uso con el
ensayo VENTANA PD-L1 (SP263) Assay.
Estabilidad de los portaobjetos con cortes
Se deben realizar secciones de aproximadamente 4-5μm de grosor y
colocarse en portaobjetos de vidrio cargados positivamente. Una vez
realizados los cortes, los portaobjetos deben teñirse lo antes posible; sin
embargo, los estudios sobre la estabilidad de los portaobjetos con cortes
realizados con portaobjetos almacenados a 2-8
o
C y 30
o
C han presentado
una tinción adecuada hasta 12meses después de la preparación para
los tejidos y 2 meses para los bloques celulares de FNA.

Guía de interpretación de VENTANA PD-L1 (SP263) Assay Staining of Non-Small Cell Lung Cancer 51
Bibliografía
1. Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0.
Cancer Incidence and Mortality Worldwide: IARC CancerBase No.
11. http://globocan.iarc.fr. Published 2013-12-12. Updated 2014-
01-09. Accessed 2016-02-08.
2. Siegel R, Naishadham D, Jemal A. Cancer Statistics, 2013. CA
Cancer J Clin. 2013;63(1):11-30.
3. Howlader N, Noone AM, Krapcho M, et al. (eds). SEER Cancer
Statistics Review (CSR),1975-2012. National Cancer Institute.
http://seer.cancer.gov/csr/1975_2012/. Published 2015-04-23.
Updated 2015-11-18. Accessed 2016-02-08.
4. Keir ME, Butte MJ, Freeman GJ, et al. PD-1 and its ligands in
tolerance and immunity. Annu Rev Immunol 2008;26:677-704.
5. Blank C, Mackensen A. Contribution of the PD-L1/PD-1 pathway
to T-cell exhaustion: an update on implications for chronic
infections and tumor evasion. Cancer Immunol Immunother.
2007;56(5):739-745.
6. Butte MJ, Keir ME, Phamduy TB, et al. Programmed death-1 ligand
1 interacts specifically with the B7-1 costimulatory molecule to
inhibit T-cell responses. Immunity. 2007;27(1):111-122.
7. Dong H, Zhu G, Tamada K, et al. B7-H1, a third member of the
B7 family, co-stimulates T-cell proliferation and interleukin-10
secretion. Nat Med. 1999;5(12):1365-1369.
8. Massard C, Gordon MS, Sharma S, et al. Safety and efficacy of
durvalumab (MEDI4736), an anti-programmed cell death ligand-1
immune checkpoint inhibitor, in patients with advanced urothelial
bladder cancer. J Clin Oncol. 2016;34(26):3119-3126.
9. Patel SP, Kurzrock R. PD-L1 expression as a predictive biomarker in
cancer immunotherapy. Mol Cancer Ther. 2015;14(4) 847-856.

Roche Diagnostics GmbH
Sandhoferstrasse 116
68305 Mannheim
Germany
www.ventana.com
© 2020 Ventana Medical Systems, Inc. y Roche Diagnostics
International, Inc. Todos los derechos reservados.
VENTANA, BENCHMARK y OPTIVIEW y el logotipo de VENTANA
son marcas comerciales de Roche. Todas las demás marcas
comerciales pertenecen a sus respectivos propietarios.
1015318ES Rev A
06/04/2020
-
 1
1
-
 2
2
-
 3
3
-
 4
4
-
 5
5
-
 6
6
-
 7
7
-
 8
8
-
 9
9
-
 10
10
-
 11
11
-
 12
12
-
 13
13
-
 14
14
-
 15
15
-
 16
16
-
 17
17
-
 18
18
-
 19
19
-
 20
20
-
 21
21
-
 22
22
-
 23
23
-
 24
24
-
 25
25
-
 26
26
-
 27
27
-
 28
28
-
 29
29
-
 30
30
-
 31
31
-
 32
32
-
 33
33
-
 34
34
-
 35
35
-
 36
36
-
 37
37
-
 38
38
-
 39
39
-
 40
40
-
 41
41
-
 42
42
-
 43
43
-
 44
44
-
 45
45
-
 46
46
-
 47
47
-
 48
48
-
 49
49
-
 50
50
-
 51
51
-
 52
52






















































